Die Allgegenwärtigkeit der Technologie ist in jeder modernen Gesundheitseinrichtung auf den ersten Blick erkennbar. Von der Prognose oder Diagnose über die Patientenüberwachung bis hin zur Verabreichung von Behandlungen - eine breite Palette softwarefähiger Geräte ermöglicht es den medizinischen Fachkräften, ihre jeweiligen Aufgaben zeitnah und präzise zu erfüllen. Die Software in einem medizinischen Gerät (SiMD) ist also eine ebenso wichtige Komponente wie die medizinische Ausrüstung selbst. Softwarelösungen, die sich nicht in einem Medizinprodukt befinden, sondern für medizinische Zwecke verwendet werden, werden als Software als Medizinprodukt (SaMD) bezeichnet. Es überrascht nicht, dass diese beiden Wunderwerke der Technik unter die strengen regulatorischen Richtlinien fallen, die für medizinische Geräte gelten.
Sowohl SiMD als auch SaMD unterliegen den Medizinproduktevorschriften des Landes, in dem sie eingesetzt werden. Zum Beispiel die Food and Drug Administration (FDA) in den USA, die Europäische Kommission in Europa und die Health Science Authority (HSA) in Singapur. Nahezu jedes Land verfügt über einen Regulierungsstandard für SaMD, aber die Vorschriften unterscheiden sich je nach den internen Gegebenheiten und dem Ansatz des jeweiligen Landes im Gesundheitswesen. Aus diesem Grund müssen sich SaMD-Anbieter an die IEC 62304:2006 halten, die eine internationale Norm ist und in vielen Ländern akzeptiert wird.
Die IEC 62304 gilt für alle Lebenszyklusprozesse. Alle SiMD-Entwickler müssen sie einhalten. In den Richtlinien der IEC 62304 werden SiMD auf der Grundlage der Sicherheit in drei Kategorien eingeteilt: A, B und C:
Zu den SiMD der Klasse A gehören solche, die für Patienten nicht gefährlich sind. Selbst wenn sie eine Gefahr darstellen, führt die Situation nicht zu einem unannehmbaren Risiko, wenn die entsprechenden Risikokontrollmaßnahmen außerhalb der Software getroffen werden. Die verschiedenen COVID-19-Diagnosekits, die seit der Pandemie wie Pilze aus dem Boden schossen, sind ein treffendes Beispiel für SiMD der Klasse A. Selbst wenn die Software, mit der die Proben analysiert wurden, fehlerhaft funktionierte und ungenaue Ergebnisse lieferte, hat sie den Benutzern keinen direkten Schaden zugefügt. Es hat lediglich dazu geführt, dass die Nutzer erst mit Verzögerung zu Medikamenten gegriffen haben, die sie bei korrekten Ergebnissen eingenommen hätten.
SiMD der Klasse B können in einer Weise gefährlich sein, die auch nach Ergreifung einschlägiger Risikokontrollmaßnahmen außerhalb der Software ein inakzeptables Risiko darstellt, aber der mögliche Schaden, der sich daraus ergibt, ist keine schwere Verletzung. So ist zum Beispiel eine übermäßige Exposition gegenüber Röntgenstrahlen für den Menschen schädlich. Wenn jedoch die Software, mit der eine Röntgenaufnahme durchgeführt wird, eine Fehlfunktion aufweist und mehr Röntgenstrahlen als beabsichtigt aussendet, führt der Schaden für den Patienten nicht zu einer unmittelbaren und schweren Verletzung.
Klasse-C-SiMD ist die kritischste. Sie umfasst Anwendungen, die gefährlich sind und zu einem inakzeptablen Risiko führen, selbst wenn alle relevanten Risikokontrollmaßnahmen außerhalb der Software getroffen wurden. Sie unterscheidet sich von Klasse B dadurch, dass die daraus resultierenden möglichen Schäden zu schweren Verletzungen oder zum Tod führen können. Die Software, die zur Durchführung von MRT-Scans verwendet wird, ist ein Beispiel für Klasse-C-SiMD. Anders als bei Röntgenstrahlen können Patienten schwer verletzt werden oder sogar sterben, wenn die MRT-Strahlung aufgrund eines Softwarefehlers das zulässige Emissionsniveau überschreitet.
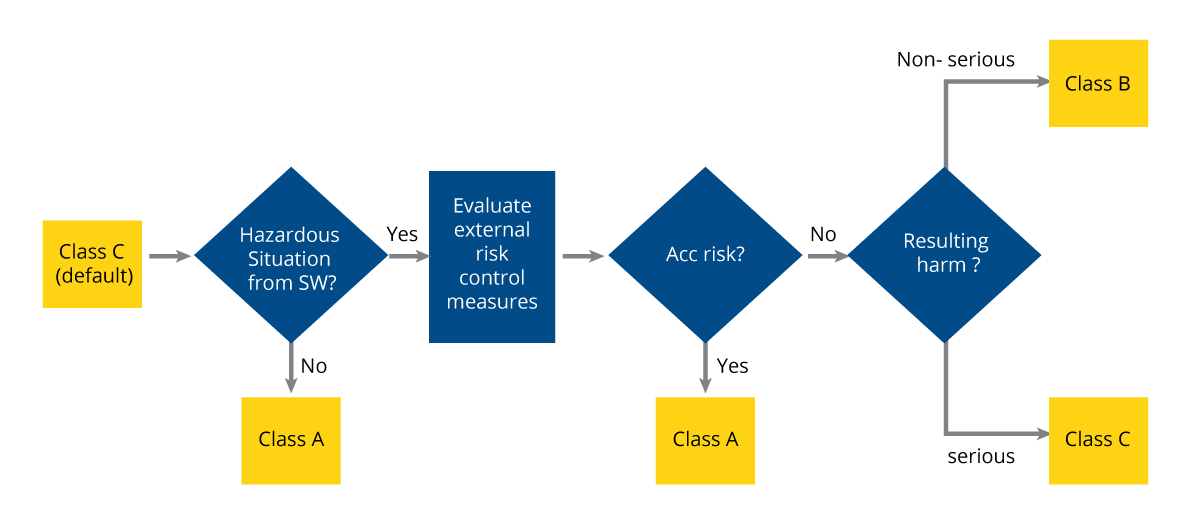
Abbildung 1: Flussdiagramm zur SiMD-Klassifizierung
Ebenso werden SiMD in vier Kategorien eingeteilt, basierend auf dem Stand der Gesundheitsversorgung und der Bedeutung der Informationen, die SiMD für die Entscheidungsfindung im Gesundheitswesen liefern. Das International Medical Device Regulators Forum (IMDRF), ein internationales Regulierungsgremium, stuft SaMD wie folgt in die Kategorien I, II, III und IV mit den Zusatzbezeichnungen "a" und "b" ein:
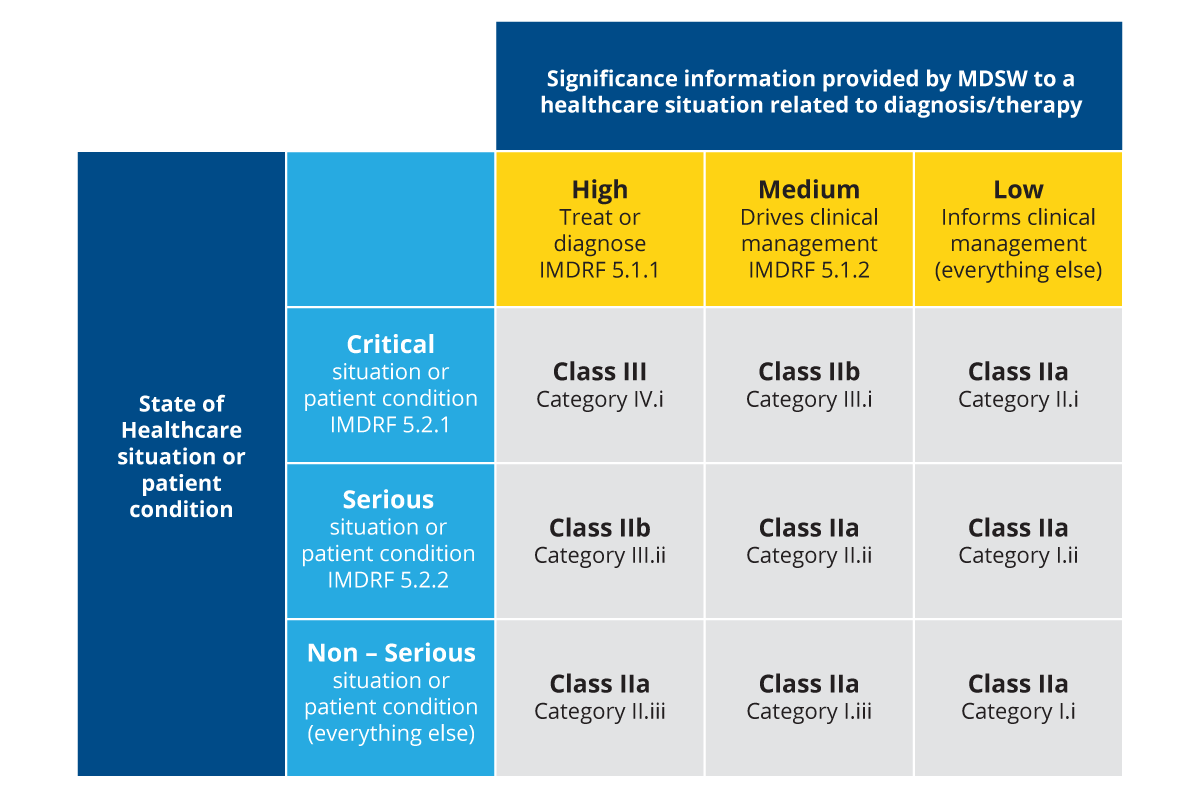
Abbildung 2: SaMD-Klassen
IEC 62304 und IMDRF greifen nicht in den Lebenszyklus der Softwareentwicklung ein. Der Entwicklungsprozess bleibt also derselbe mit den folgenden Phasen:
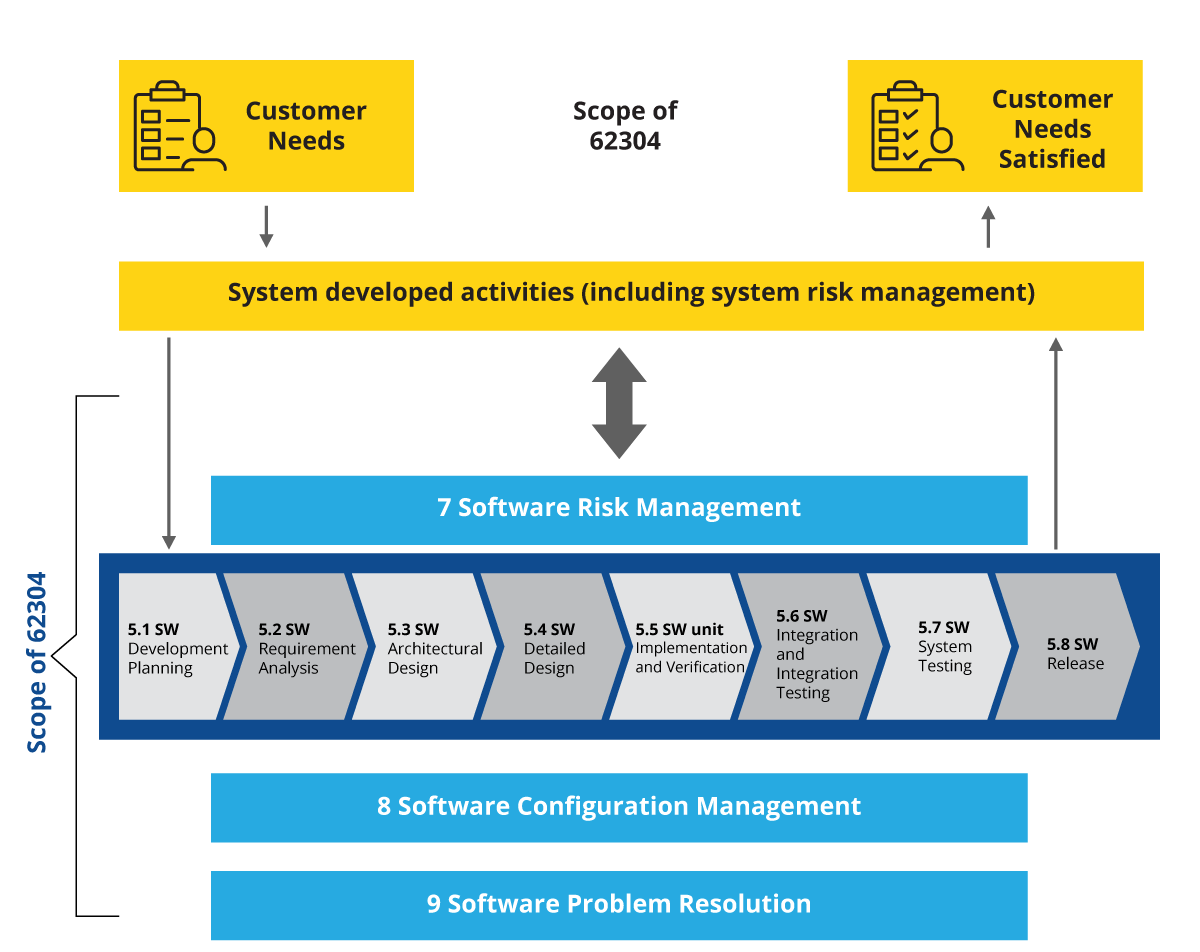
Abbildung 3: Risikomanagement-Ebene über SDLC-Phasen hinweg
Es gibt nur eine zusätzliche Schicht, die sich über alle Phasen des SDLC erstreckt und im Falle der SaMD- und SiMD-Entwicklung obligatorisch ist. Diese Ebene ist das Software-Risikomanagement. In der IEC 62304 wird das Software-Risikomanagement stark betont, und Softwareunternehmen müssen es einhalten, dokumentieren und nachweisen. Damit kommen wir zur Softwaredokumentation, bei der je nach Klassifizierung der SiMD/SaMD und des Geräts bestimmte Elemente zwingend zu dokumentieren sind. Die notwendigen Elemente für jede Klasse sind:
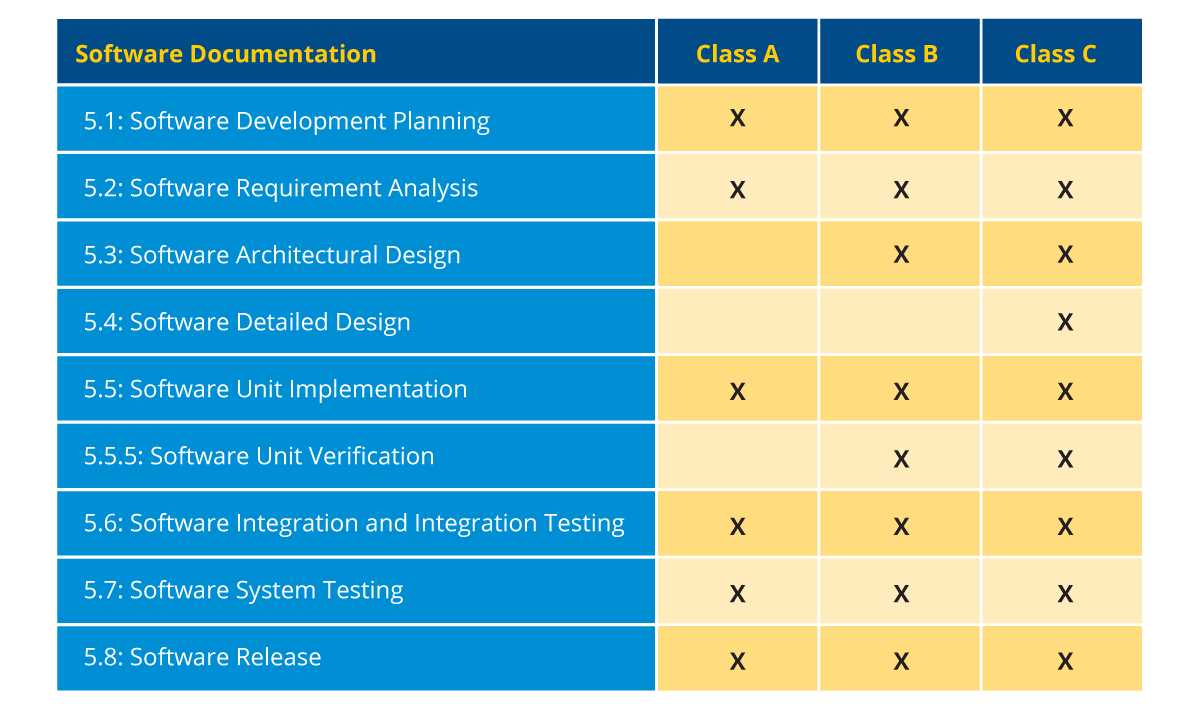
Abbildung 4: Dokumentationsanforderungen je nach Softwareklassifizierung
Die Einhaltung aller Aspekte der IMDRF und IEC 62304 in Bezug auf die Entwicklung und Freigabe von SiMD/SaMD kann ein schwieriges Unterfangen sein. Unternehmen wählen oft Software von der Stange, passen sie an und beabsichtigen, sie zusammen mit den medizinischen Geräten, die sie auf den Markt bringen wollen, zu vertreiben. Bei diesem Ansatz besteht jedoch die Gefahr, dass die Nichteinhaltung gesetzlicher Vorschriften zu einer Verzögerung der Produkteinführung führt.
Hier bietet L&T Technology Services (LTTS) mit seiner langjährigen Erfahrung und seinen bewährten Fähigkeiten bei der Erbringung von Ingenieurdienstleistungen fachliche Hilfe und Unterstützung. Mehrere Fortune-500-Unternehmen vertrauen bereits auf LTTS und verlassen sich in dieser Hinsicht auf uns. Wir decken das gesamte Anforderungsspektrum ab, angefangen bei der Neubewertung der Klassifizierung bis hin zur Bestimmung der Kategorie, zu der das betreffende SiMD/SaMD gehört. Ob es sich um eine Neuentwicklung handelt oder einfach nur um die Sicherstellung der Einhaltung der geltenden Normen, unsere Lösungen decken alles ab.
Bleiben Sie auf der richtigen Seite der Konformität und verkürzen Sie die Zeit bis zur Markteinführung Ihrer medizinischen Geräte. Finden Sie heraus, wie und was wir für Sie tun können.